Co-creation을 통한
생명과학의 혁신
- 생명과학
- 회전 디스크 공초점 시스템
- 라이프 비즈니스
- High Content Analysis CellVoyager
확인된 난치병 또는 희소병 6,000여 건 가운데 80%가 유전인 것으로 알려져 있습니다. 이러한 질병 중 하나는 근위축측색경화증(Amyotrophic Lateral Sclerosis; ALS)으로, 경우에 따라 유전되는 것으로 37세의 젊은 나이에 전설적인 야구선수 루게릭의 목숨을 앗아간 것으로 알려져 있습니다. ALS는 피해자들에게 시한부 생을 선고하는 난치병 수천 건 중 하나로, 발병하면 신체적, 정신적 능력이 점차 저하됩니다. 수십 년 동안 희소병을 앓고 있는 환자들에게는 희망의 원천이 거의 없었습니다. 그러나 최근의 기술적, 과학적 발전과 함께 희망이 보이기 시작했습니다.
iPS 세포에 대한 기대가 높아진다
― 세포를 배아 상태로 복구시킬 수 있는 기술은 희소 질환 치료의 역사적 성과
37이라는 숫자는 루게릭이 죽은 나이이며, 미켈란젤로가 시스티나 성당 천장에 마무리 손질을 했을 때, 그리고 찰스 디킨스가 그의 준자전적 소설 데이비드 카퍼필드를 출판했을 때의 나이입니다. 또한, 인간의 평균적인 정상 체온은 37℃이며, 인간의 몸은 약 37조 개의 세포로 이루어져 있습니다.
그것은 모두 하나의 수정란 또는 접합자(zygote)로 시작하여, 수정란이 분열하고 증식하여 생성된 세포가 함께 모여 배아를 형성합니다. 초기 배아를 구성하는 배아줄기세포(Embryonic Stem; ES)는 피부, 뼈, 혈액 및 심장을 이루는 특수 세포로 분화됩니다. 배아줄기세포가 한번 분화되면 이전 상태로 돌아가거나 다른 분화된 세포로 바뀔 수 없습니다. 심장 근육 세포나 신경 세포의 경우 또한 재생이 불가능합니다.
2006년 당시 교토대 프론티어 메디컬 서비스 연구소의 야마나카 신야 교수가 이끄는 연구팀은 4가지 전사 인자(100개 이상의 가능성과 순열 조합으로 인한 엄청난 경우의 수로부터 가짓수를 좁혀나감)를 도입하여 실험용 쥐의 피부 세포를 배아줄기세포와 매우 유사한 세포로 바꾸는 데 성공했습니다. 분화된 세포가 배아 환경에 적응할 수 있도록 유도한 단백질을 이용하여, 1년이 조금 지난 후 과학자들은 이전에는 불가능하다고 생각한 인간의 피부 섬유질을 사용하여 같은 결과를 얻었습니다.
이 세포들은 유도만능줄기세포(induced Pluripotent Stem; iPS)로 명명되었으며, 사실상 배아줄기세포와 구별할 수 없습니다. 두 세포 모두 다분화능(Pluripotent)을 가지고 있으며, 이는 그들이 스스로 재생할 수 있을 뿐만 아니라 성장호르몬과 다른 치료제를 통해 다른 유형의 세포로 분화될 수 있다는 것을 의미합니다. iPS 세포는 또한 무한하게 재생할 수 있습니다. 이 연구성과는 재생 의학 및 약물 개발에 대한 엄청난 기대를 불러일으켰습니다.
“iPS 세포 연구의 역사는 이제 막 시작되었으며, 이 기술은 세포 치료, 약물 검사 및 개인 맞춤형 의료에 적용할 수 있는 놀라운 잠재력을 가지고 있습니다.”
야마나카 신야(교토 대학 iPS세포 연구응용센터 소장)
2012년 12월 7일 노벨상 수상소감 연설

일본에서 거의 20년의 연구와 논의 끝에 재생의학 안전에 관한 법률(RM 법이라고도 함)이 제정된 것은 재생 의학 인프라의 발전에 있어 엄청난 진전을 보여 주었지만, iPS 세포를 재생 의학에 실제 적용하기 위해서는 아직도 많은 장애물들이 존재하고 많은 논의가 이뤄져야 합니다. 역설적으로 RM법은 나이와 관련된 황반변성(시력 저하, 현재까지 불치병 간주됨)으로 고통 받는 환자에 대한 세포 이식을 진행 중이던 사업을 중단시키는 데 기여했습니다. 이 프로젝트를 맡은 팀은 사실상 1년 내내 손실이 생겼으며, 황반변성 이식 프로젝트의 경우, 한 번의 시도에 100만 달러의 비용이 발생하였습니다. 이 프로젝트뿐만 아니라 다른 프로젝트들도 엄청난 비용 손실에 압박을 받고 있습니다.
그러나 신약 개발과 관련하여 iPS 세포의 잠재력은 현재 매우 유망합니다. 인간 세포에서 신약 후보 물질의 효능, 독성 및 안전성을 확인하기 위한 시험은 물론, 불치성 또는 난치성 질환의 치료에 사용될 신약 개발에도 iPS 세포를 사용할 수 있습니다. 이것은 배아줄기세포의 유도를 위하여 인간 배아의 사용과 임상 시험에서 동물의 사용을 둘러싼 윤리적 문제를 피할 수 있게 해주었습니다. 또한 임상 실험 프로세스를 크게 가속화 할 수 있는 잠재력이 있습니다. 약물 개발에는 최대 10년이 걸릴 수 있고 비용은 수백억원에 이를 수 있으며, 현재까지 새로운 약물 후보 물질은 사실상 공정이 끝날 때까지 인간 세포에서 실험되지 않았습니다. iPS 세포를 사용하면 개발 초기 단계에서 인간 세포에 대한 테스트를 수행할 수 있으므로 상당한 시간과 자본을 투자하기 전에 인간 세포에 적용할 수 없는 약물 후보를 제거 할 수 있습니다.
특정 질병의 치료에 있어 진전이 이루어졌으며, 상대적으로 적은 수의 사람들에게 영향을 미치는 희소 질환, 중추 신경과 관련된 질병 및 암과 같이 연구 개발이 필요한 의학 분야로 초점을 맞추는 주목할만한 변화가 진행되고 있습니다. 새로운 기술 혁신 기반으로, 발병/진행 메커니즘이 알려지지 않은 질병 분야에 대한 차세대 R&D에 대한 추진력이 높아지면 수많은 신기술이 적극적으로 활용될 것입니다.
산업과 사회를 선도하여 새로운 시대로
― YOKOGAWA의 뛰어난 기술력과 협업에 대한 열정으로 생명과학 혁신 시대의 리더로 자리매김
YOKOGAWA는 오랫동안 강점이었던 측정, 제어, 정보 기술과 핵심 세포 영상 기술을 통합해 세포 기반의 신약 스크리닝 기술을 개발하였습니다. YOKOGAWA의 생명 공학 연구 참여는 1980년대로 거슬러 올라가, 요꼬가와 쇼조 회장이 R&D 부서 생명 과학 분야에 YOKOGAWA의 전문 지식을 적용하도록 지시한 것으로 시작됩니다. 아마도 1961년 녹색 형광 단백질(Green Fluorescent Protein; GFP)가 발견하여 시모무라 오사무 박사가 노벨 화학상을 받은 것에서 생명공학 연구에 대한 동기를 얻은 것으로 보이며, 이후 많은 연구자들이 세포 연구에 몰두하였습니다.
요꼬가와 쇼조 회장은 연구진과 대학 및 외부 연구원들과의 커뮤니케이션을 통해 살아있는 세포의 고화질, 고감도 이미징이 필요하다고 판단했습니다. 이것은 세포의 시공간적 이미징 시스템을 개발하려는 목적으로 그 후 10년 동안 진행된 R&D 활동의 원동력이 되었습니다.
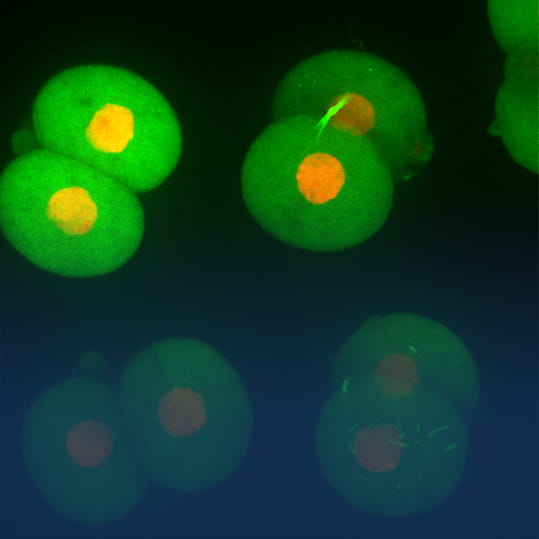
1996년에 YOKOGAWA는 자사의 공초점 스캐너 장치 시리즈의 첫 번째인 CSU10을 발표했습니다. CSU10은 수백에서 수천 개의 저전력 레이저 빔을 분산시키는 래스터 스캐닝을 이용하여 공초점 이미지를 고속으로 얻을 수 있게 했고, 검사 중인 살아있는 세포에 가해지는 손상을 줄이고, 이미지 확대가 용이해졌습니다. 그러나 회사는 거기서 멈추지 않았습니다. 그 후 20년 동안 논의, 연구 및 협업을 통해 더욱더 진화된 CSU 버전을 개발해냈습니다. 오늘날 CSU 시리즈는 세계적으로 약 3,000대를 판매한 업계 표준이 되었습니다.
2000년대 초 CSU 시리즈 공초점 스캐너 판매는 생물학 및 의료 연구에 집중되었습니다. YOKOGAWA는 이 기술을 적용 할 수 있는 다른 분야를 살펴보기 시작했으며, 결국 HCA(High-Content Analysis) 시장으로 결정했습니다. HCA는 세포 자체에서 얻은 크기, 모양 및 단백질 발현과 같은 정보를 기반으로 세포의 상태를 평가하는 방법으로, 1990년대 후반에 개발되었습니다. 이는 CSU가 제공하는 공초점 이미지를 획득하는 기능과 이러한 이미지를 분석할 수 있는 기술을 결합한 것입니다.
“약물 개발의 아주 초기 단계에서 인간 세포를 사용하는 것은 인간 세포에 적용할 수 없는 약물성분을 식별하는 데 도움이 됩니다.”
Oliver Brüstle(Bonn 의과대학 재건 신경생물학 연구소 소장)
“줄기세포-미래: iPS 세포 소개” 강의

이러한 노력으로 2009년에 HCA 방법을 사용한 고 처리량 세포 추적 시스템인 CellVoyager CV6000이 출시되었습니다. CSU와 함께 CV6000은 업계 최고의 속도와 해상도로 여러 샘플을 동시에 관찰하여 표적 분자의 수, 세포의 운동 및 형태 등의 변화를 감지 할 수 있었습니다. 스크리닝이 필요한 후보 약물이 수백만 개에 이를 수 있는 가운데, 신약 개발 과정을 자동화하고 가속화하는 추세는 활기를 띠고 있습니다. YOKOGAWA의 기술은 인력 및 비용을 절감하고, 선명한 이미징을 통해 약물의 효과를 정확하고 용이하게 확인할 수 있도록 뛰어난 해상도를 제공하며, 안전성을 보장합니다. 또한, 빨라진 처리 속도는 특정 질환을 앓고 있는 환자들의 치료를 더 앞당기는 데에 잠재적으로 기여합니다.
2010년, 세계적으로 유명한 의료 연구소 중 하나인 독일신경퇴행성질환센터(DZNE)는 YOKOGAWA의 CV6000을 약물 추적 지원 시스템 개발 프로젝트의 핵심 요소로 선정했으며, DZNE와 YOKOGAWA는 기술을 발전시키기 위해 함께 노력했습니다. 향후 몇 년 동안이 회사는 점점 업그레이드된 모델을 출시했습니다. 더 넓은 이미징 영역과 더 높은 처리량을 가진 새로운 모델을 통해 신약 개발에 필요한 요구에 부응했습니다. CV6000을 통해 개별 세포와 세포 클러스터를 관찰하고 분석할 수 있으며, 세포 배양에 최적의 환경을 찾기 위해 세포 특성을 측정하거나, 세포의 분화 정도와 양을 확인하기 위한 데이터를 수집할 수 있습니다.
YOKOGAWA의 장비와 시스템은 사용자와의 긴밀한 협력을 통해 실현되었으며, 사용자의 관점에서 목표를 달성하는 데 도움이 되도록 설계되었습니다. 이것이 품질, 속도 및 사용 편의성을 향상시키기 위한 끊임없는 노력을 이끌어낸 YOKOGAWA의 철학입니다.
YOKOGAWA는 이미징 분석으로는 불가능한 개별 세포의 정밀한 분석을 위해 단세포 질량 분석 및 단세포 유전자 분석의 개발을 추진하고 있습니다. 이를 위해 2018년 4월 시즈오카 대학과 연계하여 Single Cellome Co-innovators 컨소시엄을 설립했습니다. 도쿄 남서부 카나가와현 쇼난건강혁신단지에 위치한 이 컨소시엄의 목표는 단세포 질량 측정에 대한 축적된 전문 지식을 적용하여 개별 세포에 대한 정밀 검사를 할 수 있는 첨단 시스템을 개발하는 것입니다. 이 시스템 개발로 신약 개발을 가속화하는 데 기여할 수 있을 것입니다.
YOKOGAWA는 iPS 세포의 약물 개발 적용과 관련된 연구 지원을 하고 있으며, 도쿄대학의 미래 사회 이니셔티브의 일환으로 산학 협력 연구를 진행하는 특별 프로그램에 참여하고 있습니다. 이 프로그램의 주요 목표는 산학 협력을 통해, 주로 인간 iPS 세포에서 유래한 다양한 인간 세포를 이용하여 약물의 효능 및 독성을 평가하는 시스템을 개발하는 것입니다.
YOKOGAWA는 생명과학 분야로 진출한 이래 30년 이상 동안 개발된 정교한 기술로 신약 개발과 향후의 재생의학에 대한 가치를 극대화하고 iPS와 배아줄기세포의 잠재력을 실현하는 데 크게 기여를 할 수 있는 힘을 가지고 있습니다. 신약의 성공적인 개발을 위해서는 지식과 데이터의 공유에 있어 세계적인 규모의 협력이 필요합니다. YOKOGAWA의 공동 혁신적인 사고방식을 통해 최고의 파트너와 성공적으로 협력하여 생명 과학 분야에서 전례 없는 성과로 이어지는 시너지를 얻을 수 있습니다. YOKOGAWA는이 분야에서 가장 앞선 기술력을 바탕으로 전 세계 사람들에게 건강하고 편안한 삶을 위한 기반을 제공하는 데에 기여할 것입니다.